
Homocysteïne als integrator van vitamine B status en risicomerker
23-04-2025
Homocysteïne is een aminozuur dat niet gebruikt wordt als bouwsteen voor het maken van eiwitten. Het is daarentegen een intermediaire metaboliet in het (complexe) metabolisme van methionine en foliumzuur. Hierin spelen meerdere enzymen en cofactoren een rol (Figuur 1). Bij tekort aan foliumzuur (vitamine B9), cobalamine (vitamine B12), pyridoxine (vitamine B6), vitamine B2 en/of choline, zal homocysteïne in het bloed stijgen. Homocysteïne kan daarom geïnterpreteerd worden als “integrator” van de B-vitamine (en choline) status. Als homocysteïne laag is dan kan de status van al deze micronutriënten beschouwd worden als adequaat, als homocysteïne verhoogd is dan kan dit wijzen op een tekort van ≥1 van deze componenten.
Een andere belangrijke oorzaak van gestegen homocysteïne is verminderde nierfunctie. Vanaf dat de eGFR onder de <60 mL/min zakt is er een toename van de homocysteïne spiegel. Ten slotte hebben mensen met een genetisch lagere Methyleen Tetra Hydro Folaat Reductase (MTHFR) activiteit (c.677C>T genotype) een hoger risico op verhoogde homocysteïne waarden [1].
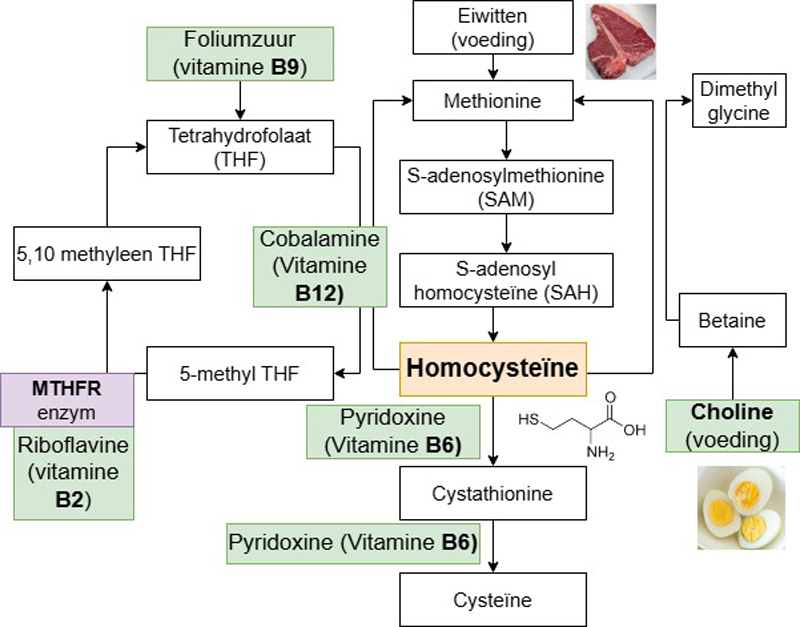
Figuur 1: gesimplificeerd schema (de realiteit is nog complexer) van homocysteïne als intermediaire metaboliet in zowel de foliumzuurcyclus (links) als de methionine cyclus (rechts). In het groen zijn de benodigde micronutriënten weergegeven. De enzymnamen werden weggelaten (behalve MTHFR). Schema op basis van Refsum et al. Clin. Chem. 2004, Rifai N. Tietz Clin. Chem. And Mol. Diagn. 6th ed. 2017 en Thomas L. Clin. Lab.
Interpretatie
Er zijn associaties beschreven tussen verhoogd homocysteïne en meer dan 100 verschillende aandoeningen, en uiteindelijk zelfs met “all-cause mortality” (Figuur 2). Voor enkele ziekten lijkt dit verband naast associatief bovendien ook causaal te zijn, op de eerste plaats vasculaire aandoeningen (veneuze trombose, perifeer arterieel lijden, coronaire artherosclerose en beroertes).

Figuur 2: mortaliteit vs homocysteïne levels. Op basis van Pusceddu et al. Eur. J. Nutr. 2020.
Hier wordt een verhoogd homocysteïne als onafhankelijke causale risicofactor beschouwd. Homocysteïne zorgt namelijk voor een inflammatie en oxidatieve stress die de vaatwand beschadigt, alsook voor endotheel dysfunctie (verminderde NO productie) . Daarnaast werd verhoogde homocysteïne intussen causaal gelinkt aan neurale buisdefecten (in de zwangerschap), maculaire degeneratie en ook cognitieve achteruitgang (met uiteindelijk dementie) door neurotoxische effecten [2].
Categorie |
µmol/L |
mg/L |
Optimaal |
<10 |
<1.35 |
Normaal |
10-12 |
1.35-1.62 |
Verhoogd |
12-16 |
1.62-2.16 |
Sterk verhoogd |
>16 |
>2.16 |
Tabel 1: interpretatie van homocysteïne waarden op basis van relatie met morbiditeit en mortaliteit in observationele studies.
Behandeling
Een causaal verband tussen verhoogd homocysteïne en het optreden van bepaalde ziekten impliceert dat verlagen van homocysteïne zorgt voor ziektebehandeling of vertraging van progressie [2]. Dit kan via een verhoogde inname (via voeding en/of supplementatie) van de hogergenoemde B-vitamines (B2, B6, B9, B12). Hierdoor wordt de enzymwerking van de enzymes in de recyclage en afbraak pathways (Figuur 1) gestimuleerd, met uiteindelijk verlagen van de homocysteïne waarde in het bloed.
Daarnaast kan ook choline deficiëntie een rol spelen bij hyperhomocysteïnemie, waardoor extra choline inname eveneens nuttig kan zijn [3]. Choline is een component van fosfatidylcholine, wat in grote hoeveelheden aanwezig is in eierdooiers, maar ook in andere voeding zoals vlees en (vette) vis, (orgaan)vlees en in mindere mate in bepaalde groenten zoals broccoli. Ten slotte kan creatine ook helpen om homocysteïne te verlagen.
Praktisch
Homocysteïne stijgt transiënt na inname van eiwitten (vooral door het aminozuur methionine), te vergelijken met glucose dat transiënt stijgt in het bloed na het eten van koolhydraten (en in dat geval niet wijst op diabetes). Om een correcte inschatting te krijgen van de homocysteïne status dient de afname daarom nuchter te gebeuren. Homocysteïne wordt in vitro verder vrijgesteld door de rode bloedcellen, waardoor er een valse-verhoging optreedt bij oude stalen, zeker bij ongecentrifugeerd serum (stijging 1 µmol/uur). Als het staal niet binnen de 1 à 2 uur gecentrifugeerd kan worden, is daarom een speciale homocysteïne buis aangeraden. Dit bevat een bewaarmiddel dat ervoor zorgt dat de homocysteïnewaarde langer stabiel blijft [1].
Het RIZIV betaalt homocysteïne enkel terug <55 jaar bij “klinische evidentie voor een vasculaire aandoening”. Indien niet voldaan aan de terugbetalingscriteria, kost deze test ongeveer €26 voor de patiënt.
Bronnen
[1] H. Refsum et al., “Facts and recommendations about total homocysteine determinations: an expert opinion,” Clin Chem, vol. 50, no. 1, pp. 3–32, Jan. 2004, doi: 10.1373/CLINCHEM.2003.021634.
[2] A. D. Smith and H. Refsum, “Homocysteine – from disease biomarker to disease prevention,” J Intern Med, vol. 290, no. 4, pp. 826–854, Oct. 2021, doi: 10.1111/JOIM.13279.
[3] M. Lever and S. Slow, “The clinical significance of betaine, an osmolyte with a key role in methyl group metabolism,” Clin Biochem, vol. 43, no. 9, pp. 732–744, Jun. 2010, doi: 10.1016/J.CLINBIOCHEM.2010.03.009.
